Хирургическое лечение рака молочной железы
•1891 г. – W. Halsted впервые опубликовал данные о хирургическом лечении больных раком молочной железы по предложенной им методике –радикальной мастэктомии с удалением обеих грудных мышц.
- ·1894 г. – W. Mayer представил свой опыт применения аналогичной операции.
• В объем удаляемых тканей при операции Halsted-Mayer включается единым блоком: – молочная железа;
– обе грудные мышцы;
– лимфодиссекция 1 – III уровней.
• В настоящее время данный тип хирургического вмешателытва выполняется при следующих клинических ситуациях:
– прорастание опухолью фасций большщй грудной мышцы или самой грудной мышцы; – большая местная распространенность процесса;
– при локализации опухоли в переходной складке в сочетании с обширной сосудистой инвазией и/или инфильтрацией опухоли окружающих тканей при интраоперационном выявлении метастатически измененных лимфоузлов.
• 1948 г- D. Patey и W. Dysson предложили свой тип операции, обладающий большей функциональной выгодностью.
- · В объем удаляемых тканей входит:
– молочная железа вместе с фасцией большой груднои` мышцы; – лимфодиссекция 1 -111 уроанеь”т,
– малая грудная мышца.
• Повременные представления о показаниях к данному типу хирургического вмешателытва сводятся в основном к следующему:
– больная предпочитает мастэктомию;
– мулыицентричный характер роста опухоли;
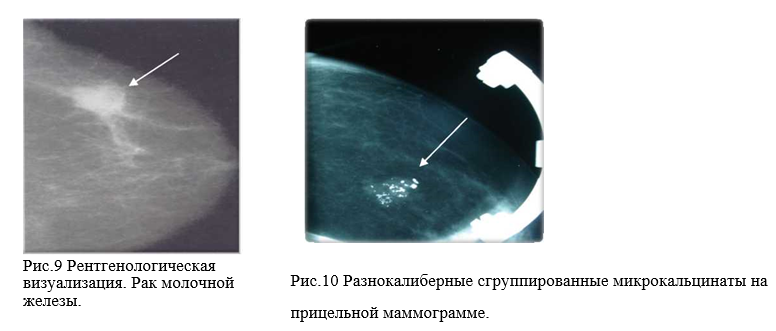
– множественные микрокальцинаты на рентгенограммах;
– центральная локализаЦия новообразования в молочной железе;
– протоковый рак т situ;
– беременность.
- Резулы атом использования подобной операции явилось:
– лучшее заживление раны;
-хорошие функциональные и косметические резулыаты;
– практически полное отсутствие лимфостазов верхней конечности.
• 1965 г. -J. Madden предложил еиде более щадящий вариант операции, стносимой к функционально выгодным – радикальную мастэктомию с сохранением обеих грудных мышц.
– лимфатические узлы подмышечной и межпекторальной облас–ги; – молочная железа вместе с фасцией большой грудной мышцы;
обе грvдные мышцы сохраняются,
-С 90-х годов в отечественной практике используется модифицированный вариант операции Маддена, ставший <золотым стандартом» хирургического лечения рака молочной железы разных стадий /В.П. Летягин с соавт., 20001.
• 13 объем удаляемых тканей при модифицированной радикальной мастэктомии с сохранением обеих грудных мышц включается в едином блоке:
и+олочная железа вместе с фасцией большой грудной мышцы;
лимфодиссекция 1-111 уровней;
– обе грудные мышцы сохраняются.
• Как и операция Patey, данное вмешателытво является функционально-щадящим, позвоr~еющим у определенного процента больных выполнить последующую реконструкщию мопечной железы.
• Подобный тип операции может быть использован при всех стациях процесса как самостоятепьно, так и как компонент комбинированной и комплексной терапии.
• Для больных с локализацией опухоли в медиальных квадрантах молочной железы в РОНЦ им. Н.Н. Блохина РАМН разработан вариант радиохирургической радикальной масэктомии (проф. . Андросов, М.И. Нечушкин(, позволяющий непосредственно воздейсто :)азть на парастернальный лимфатический коллектор:
– проводить внутритканевую лучевую терапию на область окологрудных лимфатических узлов;
-проводить визуализацию, биопсию и лимфодиссекцию в данной области с использованием эндоскопического этапа.
- · Гастэктомия без лимфаденэкrомии (простая мастэктомия) включает в себя: ,даление молочной железы с фасцией большой грудной мышцы.
• Основные показания к выполнению подобного вмешателытва:
-положнения первичного процесса (изъязвление, распад и т.д.). В данном случае она носит паллиативный характер;
-у соматически осложненных больных или пациентов в глубокой менопаузе – как компонент
знтрадикального комбинированного лечения.
Консервативная хирургия (органосохранные операции) молочной железы вошла в широкую практику с 70-80-х годов прошлого века (V. Veronesi).
- · Подобные типы оперативных вмешателытв характеризуются:
– адекватностью и достаточностью с онкологических позиций;
– блестящими косметическими результатами;
-возможностью использования практически при всех клинических стадиях, независимо от локализации опухоли в молочной железе (исключение составляют опухоли, располагающихся в центральном отделе железы).
- · К органосохранным операциям относятся:
– лампэктомия (туморэктомия):
- · удаление опухоли в пределах здоровых тканей (отступ 1 см/ + лимфодиссекция 1– 111
уровней;
-при медиальной локализации выполняется из 2-х разрезов.
– квадрантэктомия (сегментэктомия):
• удаление сектора, включающего опухолевый узел (отступ от края3 см) вместе с фасцией большой грудной мышцы + лимфодиссекция 1–111 уровней;
- · при медиальной локализации выполняется из 2 разрезов.
• В отечественной практике органосохранные операции терминологически принято называть«радикальнай резекцией».
- В объем удаляемых тканей при стандартной радикальной резекции входит:
– сектор ткани молочной железы с фасцией большой грудной мь!шцы, включающий опухолевый узел, с морфологическим и рентгенологическим контролем краев резекции; – лимфодиссекция 1 -III уровней.
- Всем ли бопьным можно сохранить молочную железу?
- Принципиальным в выборе больных – кандидатов на органосохранное хирургическое
вмешателытво является стадия опухолевого процесса и локализация новообразования.
- Возраст не имеет принципиального значения.
• Современные противопоказания к выполнению радикальной резекции включают в себя следующее:
– центральная локализация опухоли;
– мужской пол пациента;
– заведомо неудовлетворительнь!е косметические результаты;
– истинно отечно-инфильтративный и воспалительный рак молочной железы;
-мультицентричный характер роста;
– неблагоприятные рентгенологическиепризнаки (множественные микрокальцинаты,заинтересованность центральных отделов).
• Принципиальным отличием консервативных хирургических вмешателытв от радикальной мастэктомии является сохранение части органа с последующим косметическим формированием молочной железы.
Встает закономерный вопрос: достаточно ли подобной локальной методики или необходима комбинаиия с лvчевой терапией в целях максимального контроля локального рецидивирования?
- · Лучевая терапия должна быть неотъемлемым компонентом, дополняющим органосо
хранную операцию,при всехстадиях:
– при отсутствии адъювантного облучения у больных стадии Т1 NOMO число локальных рецидивов возрастает до 8% (против 4% у облученных пациенток); – при 11А стадии – до 25%, т.е. у каждой четвертой больной.
• Самым неприятным осложнением комбинированного лечения с использованием органосохранных операций являются лучевые изменения:
– кожные реакции;
– фиброз, иногда значительно нивелирующий косметические результаты.
- Подобные осложнения чаще всего связаны:
– с большой резекцией при небольшой железе;
– с СОД-лучевой терапии более 50 Гр;
– с РОД-лучевой терапии более 2 Гр.
В каких спучаях все же можно ограничиrься радикапьной резекцией без адьювантного
облучения?
-У больных в глубокой менопаузе, особенно при положительныхстероидных рецепторах в
опухоли, комбинация радикальная резекция + гормонотерапия (тамоксифен) демонстрирунп удовлетворительные показатели выживаемости (85% – общая и 82,9% – безрецидивная ,-летняя выживаемосты.
• При выполнении радикальной резекции у первично неоперабельных больных (1{1 стадия: 12N2M0, T3N1 МО, исключая Т4):
-лучевая терапия используется как компонент неоадъювантного лечения (вместе с химиотерапией);
-соответственно необходимость в послеоперационном облучении подобных пациенток решаеrся индивидуально.
- ·Хирургические осложнения после консервативных операций возникают в значительно
меньшем проценте случаев, чем после радикальной мастэктомии.
- · Крайне редким осложнением при органосохранных операциях является некроз лоскута,
значительно менее выражена лимфорея.
Лучевая терапия рака молочной железы
Лучевая терапия – неотъемлемый компонент комбинированного лечения рака молочной железы.
• Основная цепь метода- контроль локального рецидива после выполнения хирургического вмешательства.
- Число локальных рецидивов при выполнении органосохранных операций без адъювантного облучения составляют 43%.
• Число местных рецидивов после выполнения радикальной мастэктомии y больных c поражением регионарных лимфатических узлов (более 4) без последующей лучевой терапии
соответствует 35%.
• Основными задачами метода следует считать:
при ранних формах (Т1, Т2) – деструкция возможно имеющихся микроскопических раковых очагов в органе (мультицентрический процесс) или субклинических отсевов пеpвичной опухоли;
– при первичных местно-распространенных операбельных карциномах (ТЗ) – девитализация опухолевых клеток, несущих опасность диссеминации во время операции, разрешение микродиссеминантов, возможно, оставшихся во время операции в целях повышения абластичности выполнения хирургического вмешательства;
-при первично нерезектабельных опухолях (Т4) – максимальное разрушение опухолевых тканей для достижения возможностей радикальной операции или полная деструкция опухолевых клеток при куративном лечении;
-при наличии отдаленных метастазов – достижение паллиативного или симптоматического эффектов;
– при необходимости проведения гормонального лечения – выключение функции яичников.
• Может применяться в качестве компонента комбинированной и комплексной терапии либо в самостоятельном виде.
- Существует 3 метода комбинированного лечения:
– предоперационное облучение c последующим хирургическим вмешательством;
– операция c последующей лучевой терапией;
-лучевая терапия, проводимая до и после хирургического этапа.
• Применяемые методики включают:
– лучевую терапию укрупненными фракциями РОД 5-10 Гр до СОД 20 Гр;
– лучевую терапию в режиме обычного фракционирования РОД 2 Грея до СОД 50-70 Гр.
• Основной механизм действия:
– гибель малодифференцированных анаплазированных клеточных популяций;
– подавление роста микрометастазов в лимфатических узлах и лимфатических сосудах.
- · Предоперационное крупнофракционное облучение позволяет:
-увеличить пpоцeнт больных – кандидатов на органосохранное оперативное вмешательство;
-снизить число локальных рецидивов в среднем в 2-3 раза (8% против 18%).
[Даценко B.C/I Bonp. онкол., 36/12(:1448-1454, 1990; Calitchi Е. et а1.// Pathol. Boil., 38(8): 839-840, 1990; Семиглазов BED/I Terra Мед., 2: 6-8, 1996.]
- Наиболее часто облучение применяется при выполнении органосохранных оперативных
вмешателытвах РОД 2 Гр до СОД 50 Гр (на молочную железу): – регионарные зоны в программу лучевой терапии включаются:
- при медиальной локализации опухоли (облучение парастернальных лимфатических узлов РОД 2 Гр до СОД 46 Гр);
•при поражении регионарных лимфатических узлов – облучение зон регионарного метастазирования РОД 2 Гр до СОД 46 Гр.
- · 26% местных рецидивов локализуется вблизи ложа удаленной опухоли.
- · При отказе от облучения после экономных операций локальный рецидив развивается у
15-40% больных.
• Лучевая терапия после сохранных операций показана начиная с 1 стадии инвазивного (а иногда и преинвазивного) рака молочной железы:
– число местных рецидивов при отсутствии адъювантного облучения при Т1 NOMO возрастает до 4% (против 2%, когда используется комбинированное лечение).
- · Эффективность и влияние облучения на косметические резулыаты оцениваются согласно рекомендациям:
– превосходный вид молочной железы – вид леченной железы практически идентичен
здоровой;
– хороший – имеются незначительные различия межцу здоровой и леченной железами;
-достаточный – имеются очевидные различия между здоровой и леченной железами;
– плохой – имеются серьезные изменения в молочной железе после лечения.
• Применение лучевой терапии после радикальной мастэктомии рекомендуется: – при высокам риске вазникновения покального рецидива:
- · центральная и медиальная локализация опухоли (облучение парастернального коллектора обязательно в связи с высоким (почти 55%) риском метастазирования в зту зону(;
• пременопаузальным больным с позитивными регионарными лимфатическими узлами и величиной первичного очага соответствующей ТЗ (более5 см);
• пременопаузальным больным с поражением более 4 регионарных лимфатических узлов;
- · пременопаузальным пациенткам с неадекватно выполненной лимфодиссекцией;
- все случаи местно-распространенного рака молочной железы (III стадия);
- у постменопаузальных больных с аналогичными критериями повышенного риска локального рецидивирования.
•В качестве самостоятельного метода дистанционная гамма-терапия применяется не часто.
Показаниями к подобней консерваrивной rерапии явпяюrся:
– пожилой возраст и наличие тяжелой сопутствующей патологии, абголютные противопоказания к оперативному вмешателытву;
-больной от хирургического лечения;
– неоперабельная или инфильтративно-отечная формы рака молочной железы.
- · Подобный способ лечения, несомненно, целесообразен у больных, находящихся в глубокой менопаузе, для которых: данная терапия – единственный способ радикального лечения;
-лучевая терапия может быть использована при любой стадии процесса:
∎ исключением являются осложненные опухоли (изъязвления,распад,кровотечениеl; – данная методика, особенно в комбинации с гормонотерапией (тамоксифен 20 мг/сут длиельно при положительных ER), позволяет добиться высоких отдаленных результатов (5летняя общая и безрецидивная выживаемость составляет при Т1-2NOM0-83,3% и 83,3% соответствflнно, при T1-2N1 МО – 80,5% и 77,6% соответственно, для местно-распростра{енного рака (111 стадия) – 70,4% и 67,7°/о соответственно).
• Один из возможных путей повышения эффективности лучевой терапии – локальная гиnептермия.
• В основе метода лежат данные, свидетелытвующие о том, что перегревание опухоли значительно усиливает повреждающее действие ионизирующих излучений.
• Облучение парастернальных лимфатических узлов и ложа удаленной опухоли может прогдодитыя с использованием брахиотерапии (boost) СОД 60 Гр.
• Аппараты «Микроселектрон», «Гаммамед», использующие Cs137, Со60, 1г192, работающие по принципу after loading, позволяют наиболее оптимально и максимально щадяще ~роводить внутритканевое облучение как цепочки окологрудных лимфатических узлов, так и ложа удаленной опухоли, в частности, у больных с медиально-центральной локализацией
опухоли:
– подобный способ контактной лучевой терапии является эффективным и максимально щадящим для окружающих анатомических структур.
- Наиболее грозными осложнениями пучевой терапии следует считать постлучевые изменения легочной и сердечной ткани:
-лучевой пульмонит:
- чаще протекает с клинической симптоматикой сухого кашля, субфебрилитета;
- встречается не более чем в 1% случаев при адекватно выбранной методике облучения;
– лучевой фиброз:
- · чаще развивается отсрочено;
- · клиническая симптоматика крайне скудная или отсутствует;
– радиоиндуцированная карцинсма:
- · риск развития подобного заболевания возрастает не более чем на 0,2% в течение 10 лет.
Химиотерапия первичного рака молочной железы
. усоовчая теория биологии рака молочной железь -системный характер процесса (Fisher В.).
Рандомизированные исследования 70-х годов прошлого века убедительно продемонстриро что химиотерапия достоверно увеличивает продолжительность жизни больных пременопаузального и пожилого возраста с пораженными регионарными лимфатическими узлами.
- · Оновными задачами химиотерапии следует считать:
-профилактику метастатической болезни (неоадъювантная, адъювантная);
– наиболее эффективное воздействие на опухолевую ткань в целях сокращения стадии заболевания и более широкого использования органосохранных операций (неоадъювантная);
– полvчение как можно более выраженного ответа на предоперационную терапию при лечении неопеиабельного рака молочной железы, е частности диффузных форм (неоадъювантнаяl.
• Основными вариантами подобной терапии являются:
– неоадъювантная (предоперационная) химиотерапия, применяемая:
- при операбельном раке (ТО-3N0-2М0) в цвлях уменьшения стадии болезни и выполнения органосохранного оперативного вмешателытва;
- при неоперабельном (T4N0-2М0, ТО-4N3M0) раке в целях наиболее эффективного
воздействия на первичный очаг и регионарные метастазы для последующего выполнения хирургического вмешателытва, а также для оценки индивидуа.пьной чувствительности к проводимому лечению (с возможной коррекцией или интенсификации его).
• Применение системной химиотерапии (и эндокринотерапии) базируется на ряде прогностических факторов:
-наличие и число пораженных регионарных лимфатических узлов;
-размер первичной опухоли (для пациенток с NO);
– степень дифференцировки опухоли;
– возраст больной;
-нагичие или отсутствие рецепторов к стероидным гормонам в опухолях.
• 3ыбор адъювантной терапии у больных без поражения регионарных лимфатических узлов зависит от:
– низкого или высокого прогностического риска.
- · Низкий риск прогрессирования характеризуется:
- · Т <2 см;
- возраст > 35 лет;
- I степень дифференцировки;
- PЭ -и/или РП-положительностью.
- Высокий риск характеризуется:
- РЭ- и РП-отрицательностью;
- Т >2см;
- возраст < 35 лет;
- степень дифференцировки – II-III;
• Для категории низкого риска больных без поражения регионарных лимфатических узлов
возможно:
– отсутствие системного адъювантного лечения;
– гормонотерапия (тамоксифен) при P3+ и/или РП+.
- · У больных высокого риска без поражения регионарных лимфатических узлов адекватно:
– для пременопаузальной группы:
- химиотерапия (6 циклов АС, FAC или CMF при РЭ-РП-);
• химиогормонотерапия (6 циклов АС, FAC или CMF + тамоксифен 5 лет);
– у больных в постменопаvзе:
- тамоксифен не менее 5 лет (при P3+ и; или РП+);
• химиотерапия с последующим назначением тамоксифена;
– в группе старше 70 лет:
- тамоксифен (при P3+ и/или РП+);
- вопрос о химиотерапии при етрицательных стероидных рецепторах обсуждается индивидуально, с учетом соматической патологии а каждом конкретном клиническом случае.
• Прогноз больных раком молочной железы с метастазами в подмышечные лимфатические узлы в первую очередь зависит от числа пораженных регионарных лимфатических узлов:
– меньше 4;
– 4 и более.
• Основным вариантом системного адъювантного лечения больных в пременопаузе с поражением регионарных лимфатических узлов является:
– химиотерапия (при РЭ-FП-): 6 циклов CAF, или АС, или классического CMF при поражении менее 4 лимфатических узлов;
– химиотерапия (при РЭ-РП-): 4 курса доксорубицина с последующим использованием 8 курсов CMF (или комбинации с включением таксанов).
• Для постменопаузальных больных с поражением регионарных лимфатических узлов тактика адъювантной терапии следующая:
– тамоксифен не менее 5 лет (при положительных стероидных рецепторах);
– 4 цикла АС или FAC (при отрицательных стероидных рецепторах, поражении более 4 регионарных лимфатических узлов и отсутствии серьезной сердечно-сосудистой патологии).
- Больным пожилого возраста (старше 70 лет):
– при наличии рецепторов в опухоли назначается тамоксифен, а в последние годы стали применять ингибиторы ароматазы (фемара);
– при выcоком риске рецидива (более 4 лимфатических узлов, отрицательные стероидные рецепторы), а также отсутствии серьезной сопутствующеы патологии возможно применение химиотерапии.
- В качестве предоперационного компонента комплексного лечения нео-адъювантная (ин
дукционная)химиотерапия применяется:
– у операбельных больных в целях уменьшения стадии болезни и выполнении в последующем органосохранного вмешателытва, при морфологически подтвержденном полном или частичном регрессе опухоли:
∎ NSABP В-18: чаcтота объективных эффектов первичной опухолей на химиотерапию составила 80%, полная клиническая регрессия регионарных лимфатических узлов отмечалась в 76°ro клинических случаев, из которых морфологически подтверждена практически половина (32%).-
– в неоперабельной группе:
- увеличение числа радикально оперированных 5ольнык,
- уменьшение частоты возникновения метастазов;
- · увеличение продолжительности жизни леченых больных.
- ·Наибольшей популярностью в качестве неоадъювантной химиотерапии пользуются режимы СMFVP, FAC, СMFAV, АС 4 цикла, сМР (28-дневный), FEC, cEF, Ат, TAC, CVAP+Т
- · Предоперационно используется,как правило,несколько циклов химиотерапии:
-если используются пролонгированные режимы (CMFVP, CMFAV и r.ц.), возможно применение одного цикла.
- Оценку эффективности цитостатическог о лечения производят через 2 цикла.
• В последнее время все чаще используют комбинации схем с антрациклинами (АС), после чего используются таксаны (доцетаксел), т.е 4 цикла АС + доцетаксел.
• После вьfiелнения оперативного вмешателытва химиотерапия продолжается в адъювантном режыме (не менее 4 циклов АС).
- · Наиболее зффективным считается применение индукционной химиотерапии, особенно в
группе первично несперабельных больных в комбинации с облучением молочной железы и
зон регионарного метастазирования РОД 2 Гр до СОД 50-0 Гр.
–АС:
- доксорубицин 60 мг/м’ в/в в 1-й день;
- · циклофосфан000 м;’м в/в в 1-й день;
- 4 цикла с интервалом между курсами 21 день.
- схема используется как самостоятельно, так и с последующим проведением 4 циклов
доцетаксела(АС + доцетаксел).
–CAF:
- циклофосфан 100 мг/м` per os с 1-го по 14-й день;
- доксарубицин 30 мг/м` вjв в 1-й и 8-й дни;
- 5-фторурацил 500 мг/мn в/в в 1-й и 8-й дни;
- · 6 циклов с интервалом между курсами 28 дней;
о возможно применение однодневного щикла CAF с в/венным ваедением всех препаратов
в один день или недельный циюi.
– FAC:
- 5-фторурацил 500 мг/мn в/в в 1-й и 8-й дни;
- доксорубицин 50 мг/м’ в/в в 1-й день;
- циклофосфан 500мг/м2 в/в в 1й и 8й дни;
- 6 циклов с интервалом между курсами 21 день.
– FEC:
- · 5-фторурацил 500 мг/м в/в в 1-й и 8-й дни,
- · эпирубицин 60 мг/м° в/в в 1-й и 8-й дни;
- · цикпофосфан 500 мг/м в;в в 1-й и 8-й дни;
- · 6 циклов с интервалом между курсами 28 дней.
– CEF:
- · циклофосфан 500 мг/м в/в в 1-й день;
- · эпирубицин 75 мг/м’ в/в в 1-й день;
- · 5-фторурацил 500 мг/м в/в в 1-й день;
- · 6 циклов с интервалом между курсами 21-28 дней.
• В настоящее время наиболее эффективными препаратами в лечении как метастатическогп, так и первичного рака молочной жплезы считаются таксаны (в частности, доцетаксел (таксотер))
– ТАС;
- · доцетаксел 75 мг/м2 в;в, в 1-й день;
- · докспрубицин 50 мг/м2 в/в, в 1-й день;
- · циклофосфан 500 мг/м2в/в, в 1-й день;
- · 6 циклов е интервалом междv курсами 21 день.
-терапия ТАС позволяет на 32% снизить относительный риск рецидива заболевания (р < 0,001)у больных с поражением регионарных лимфатических узлов:
- ·на 50% – при поражении 1-3 лимфатических узлоа;
• на 14% – при поражении более 4 лимфатических узлов.
– Применение доцетаксела в неоадъювавтном режиме после схеме АС демонстрирует увеличение частоты клинического зффекта (ПЭ) до 65% по сравнению с 40°%, где данный препарат не использоаапся;
– среди больных, получавших до операции доцетаксел, у 19% не найдено микроскоппческих признаков опухоли, что почти в 2 раза выше, чем у больных, пплучавших только АС
– AT:
- · доксорубицин 50 мг/м2 в/в, в 1-й день;
- · доцетаксел (таксотер) 75 мг/м в/в, в 1-й де.нь;
- ·6 циклов с интервалом между курсами 28 дней
– CVAP + доцетаксел:
- ·циклофосфан 1000 мг/м2 в/в, в 1-й день;
- · доксорубицин 50 мг/м в/в, в 1- й день;
- винкристин 1,5 мг/м2 В/в, в 1-й день;
- преднизолон 40 мг per оs с 1-го по 5-й дни;
- · 4 цикла с интервалом между курсами 21 день, а затем
- · доцетаксел 100 мг/м2в/в, в 1-й день;
- · 4 цикла с интервалом между курсами 21 день.
• Повышение эффективности химиотерапевтическдго лечения связано с нескoлькими позициями:
-увеличение числа курсов предопераципнной химиотерапии;
-использование современных высокоэффекгивных препаратов, например таксанов (в монорежиме, а лучше в комбинации, в частности, с антрациклинами);
-более тчательный отбор больных с предсказательными факторами высокой зффективности данного вида терапии;
– ранняя оценка эффективности проводимой прецопераципнной терапии.
Заключение
• Основные тенденции развития лекарственного лечения в конце ХХ – начале ХХI в.:
– значительное расширение классификации противоопухшлевых агентов;
– нарастание каскада новых противоопухолевых агентов, направленных на молекупярные и генетические мишени опухолевого роста;
– внедрение средств биологической терапии – новые виды иммунотерапии, моноклональные антитела, ингибиторы металлопротеаз, киназ, ангиогенеза, дифференцирующие агенты и др.;
– изменение традиционной методики испытаний новых противоопухолевых препаратов (I-III фазы) и оценки их клинической зффективности (оценка длительности стабилизации);
– расширение исследований и расширенг!е показаний пе неоадъювантной химиотерапии, совершенствование режимов адъювантной химиотерапии;
– предварительное определение наличия или активности мишеней опухолевпго роста (ферментов, рецепторов, онкогенов, антигенов и др.) с целью определения чувсгвительности кконкретному препарату;
– комбинации биологических и цитологических агентов.
Гормонотерапия рака молочной железы
- Гормоночувствительность клеток рака молочной железы определяется наличием в их
мембране рецепторов к эстрогенам (РЭ) и прогестерону (PH).
- Гормонотерапия эффективна в среднем у 1/3 больных.
• Эффективность этого метода при наличии в опухоли рецепторов составляет 60-70%:
– если присутствуют рецепторы одного типа, эффективность снижается до 33°%;
– приблизительно 11 % рецептор отрицательных опухолей отвечает на применение гормонального лечения.
• Содержание рецепторов к стерсидным гормонам в разных возрастных группах различно:
– у 45% больных в пременопаузе и у 63% пациенток в постменопаузе опухолевые клетки
содержат рецепторы;
-у 7,8°/о больных в пременопаузе и у 17% в постменопаузе рецепторы отрицательны.
• При невозможности лаборатерно установить факт наличия рецепторов к эстрогенам и/или прогестерону ориентируются на косвенные признаки гормоночувствительности:
– пожилой (постменопаузальный) возраст;- длительное «мягкое» течение заболевания;
– преимущественное прогрессирование в кости и мягкие ткани.
- · Основными механизмами препаратов, используемых в качестве гормонотерапии, являются:
– конкурентное связывание рецепторов на поверхности клетки(тамоксифен,зитазониум, нолвадекс и т.д.);
– ингибирование ароматазы – фермента, ответственного за преврашение андрогенов в эстрогены (аминоглутетимид, форлистан, летрозол и т.д.);
– снижение уровней эстрогенов (один из механизмов действия прогестинов (фарлутал, мегейс и т.ц.).
• Назначение гормонотерапии в разных возрастных группах (особенно гормонотерапии первой линии) несколько отличается:
-у молодых менструирующих женщин применение, в частности, антиэстрогенов более зффективно при предшесствующем выключении функции яичников (кастрация);
– у больных менопаузальной группы в подобной процедуре нет необходимости.
- · Выключение функции яичников как гормонотерапия первичного и метастатического рака
молочной железы известно 6олее100 лет.
•1896 г. G.T. Beatson выполнил овариоэктомию при лечении молодых больных генерализованным раком молочной железы.
- Выключение функции яичников может осуществляться различными способами:
– хирургический (лапароскопическая или лапаротомическая овариоэктомия);
– лучевой (облучение яичников с двух тангенциальных полей СОД 16 Гр);
– химический (применение агонистов гонадотропин-релизинг гормонов гипофиза).
• Преимущества того или иного вида выключения яичников спорны, однако:
– у женщин моложе 35-40 лет более предпочтительным можно считать хирургический способ выключения овариальной функции;
-в более старшей везрастной группе-лучевая кастрация.
- · Частота эффектов при хирургическом и лучевом методе составляет 35% и 16°Г соответственно.
- · Эффект при облучении яичников развивается на 2-8 недель позднее.
- · В отличие от предыдущих методик, химическая кастрация обратима.
- · Основным механизмом ее является подавление секреции гонадотропинов.
• Эффективность монотерапии золадексом в дозе 3,6 мг 1 раз в 28 дней под кожу живота составляет около 40%.
• Показаниями к выкпючению яичников следует считать:
– молодой возраст и сохранная менструальная функция;
– положительные стероидные рецепторы.
Антиэстрогены
• «Золотым стандартом» при проведении гормонотерапии I линии по-прежнему остается тамоксифен (нолвадекс, зитазониум).
• Механизм его действия состоит в конкурентном ингибировании специфических рецепторов эстрогенов, находящихся на поверхности опухолевой клетки.
- ·Данный механизм хорошо изучен.
- ·Имеется ряд сведений о наличии у тамоксифена ряда эффектов.
– индуцирование апоптоза;
– ингибитор факторов неоангиогенеза;
– цитостатический эффект;
– повышает экспрессию ингибитора факторов роста (TGF-b);
– снижавт секрецию стимуляторов ростовых факторов (TGF-a, IGF-I, IGF-II, PDGF);
– ингибитор множественной лекарственной резистентности.
• Применение тамоксифена в дозе 20 мг/сут не более 5 лет позволяет на 50% снизить вероятность возврата заболевания и на 25% показатель смертности от рака молочной железы.
- · У 10-15% гo больных распространенным раком молочной железы наблюдаются объективныв ремиссии при рецепторотрицательных опухолях.
• Использование тамоксифена в возрастной группе после 50 лет с низким уровнем эстрогеновых рецепторов сокращает ежегодный показатель смертности на 16°/о.
- · Применение тамоксифена у женщин в пре и постменопаузе с ER+ и ER- сокращает вереятность поражения противоположной молочной железы;
-на 13%- в течение 1 года;
-на 26%-в течение 2 лет;
-на 47%- при 5-летнем использовании.
• Продолжительнссть приема тамоксифена в стандартной дозе 20 мг/сут не должна быть меньше 5 лет.
- ·Причинами отмены препарата могут быть:
– возникновение гинекологической патологии (дисфункциональные маточные кровотечения на фоне атипической гиперплазии эндометрия);
-выраженный гиперкоагуляционный синдром;
– прогрессирование заболевания на фоне приема препарата.
- ·Наиболее значимые побочные эффекты терапии тамоксифеном:
-Рак эндометрия;
-рак печени;
-тромбооэмболии.
– с1997 г. широко применяется в качестве гормонотерапии 1 линии у постменопаузальных больных при положительных стероидных рецепторах в опухоли;
– рекомендуемая стандартная доза препарата – 60 мг/сут;
– рекомендуемый интервал приема – не менее 2 лет;
– от тамоксифена отличается более мягкими побочными эффектами со стороны сердечно-сосудистой и генитальной систем.
– нестероидный антиэстроген;
– обладает антипролиферативной активностью;
– не повышает риск индукции карциномы эндометрия.
Заключение
- Применение тамоксифена в качестве гормонотерапии эффективно вне зависимости от возраста.
• Базовым критерием назначения подобного лечения должны быть сведения о рецепторном статусе опухоли (положительные стероидные рецепторы).
• Эффективным интервалом может считаться использование тамоксифена не менее 5 лет в стандартной дозе 20 мг/сут.
– по механизму действия схож с тамоксифеном;
– практически не индуцирует карциномы эндометрия и печени.
Ингибиторы ароматазы
• Механизм действия препаратов данной группы связан с ингибированием фермента ароматазы, ответственного за превращение андростендиола и тостостерона в эстрон и эстрадиол;
-угнетение данного фермента приводит к количественному снижению эстрогенов и замедлению роста опухоли в случае ее гормоночувствительности.
• Ингибиторы ароматазы не должны назначаться молодым менструирующим женщинам, поскольку снижение продукции эстрогенов, в частности в жировой ткани, неминуемо приведет к увеличению их продукции в функционирующих яичниках (эффект «обратной связи» ).
- Все ингибиторы ароматазы делятся на.
-стерпидные (форлистан, экзелистан);
-нестероидные (оримитен, фадразол, аримыдекс, летразол и т.д.).
- Обе группы препаратов используются в качестве гормонотерапии II линии у постменопаузальных больных с положительными рецепторами в опухоли.
- В настоящее время появились рандомизированные исследования, посвященные применению ряда нестероидных ингибиторов ароматазы (летрозол, анестрозол) в качестве гормонотерапии 1 линии в группе менопаузальных пациенток, опухоли которых содержат стероидные рецепторы.
• Наиболее известными представителями селективных нестероидных ингибиторов ароматазы являются:
– Летрозол (фемара) – синтетическое производное бензгидрилтриазоля
- · механизм действия: полная блокада цитохрома Р450 ароматазы;
- · стандартная доза препарата – 2,5 мг per os ежедневно;
- · интервал приема – не менее 2 лет,
- · не снижает продукцию кортизола;
• применяется у постменопаузальных больных при положительных стероидных рецепторах в качестве:
- гормонотерапии II линии (прогрессирование на фоне +амоксифена);
- гормонотерапии I линии в той же группе больных;
- основные побочные эффекты, которые необходимо учитывать:
- вагинальные кровотечения.
Анастразол (аримидекс) – нестероидный селективный ингибитор ароматазы II типа:
- ее влияет на уровень кортизола;
- применяется в основном у постменопаузальных пациенток;
- при использовании в группе пременопаузальных5ольных целесообразнее комбинировать его с агонистами рилизинг-гормонов 4золадекс);
- наиболее часто используемая доза -1 мг per os ежедневно;
- интервал приема – не менее 2 лет.
- · Из селективных ингибиторов ароматазы первого и второго поколения наибольшей популярностью пользуются:
– Форлистан-стероидный ингибитор ароматазы первого поколения.
• на 85% ингибирует процесс ароматизации, снижая продукцию зстрадиола на 65%;
• чаще всего используется у менопаузальных больных с положительными стероидными рецепторами в опухолях в качестве гормонотерапии II линии (прогрессирование на фоне тамоксифена или после отмены тамоксифена).
– Фадразол– нестероидный селективный ингибитор ароматазы второго поколения:
- · эффективно блокирует фермент;
- · не влияет на содержание АКТГ;
- незначительно снижает продукцию кортизола.
– Аминоглутетимид (цитадрен) – неселективный нестероидный ингибитор ароматазы .
• имеет самую длинную историю своего использования, так как является практически первым представителем данного класса препаратов;
- ·механизм действия связан с угнетением эстрогенсинтетазы;
• значительно влияет (снижает) уровень кортизола, поэтому всегда применяется вместе с кортикостероидами;
• стандартный режим применения: 1 мг цитадрена в комбинации с 40 Mr гидрокортизона длительно;
- ·рекомендации к применению – постменопаузальным больным с ER+;
- ·в настоящее время в связи с выраженными побочными эффектами, необходимостью
заместительной гормонотерапии, а главное, появлением селективных ингибиторов ароматазы практически не используется.
-Экземестан(аромазин)-один из самых новых стероидных ингибиторов ароматазы третьего поколения первого типа:
- ·может считатся инактиватором ароматазы;
- ·эффективен при использовании после анастрозола и летрозсла;
- ·средняя стандартная доза препарата – 25 мг/сут per os.
Прогестины
- · В настоящее время эта группа препаратов относится к гормонотерапий III линии.
- · Прогестины – гормоны желтого тела или их аналоги.
- · Механизм их действия до конца не ясен, но известно, что:
– они способствуют снижению уровней эстрогенов и глобулина, связывающего половые стероиды;
– уменьшают секрецию гонадотропинов и АКТГ;
-уменьшают внутрипеченочный синтез зстрогенов из андрогенов;
-в определенной степени облацают прямым цитостатическим эффектом;
-влияют на ростовые факторы (IGF-I, TGF-a)
• В эту группу входят мегестрол ацетат (мегейс) и медроксипрогестерона ацетат(фарлугал,провера).
• Эффективность их приблизительно одинакова (28% и 33% соответственно):
– мегейс применяется в дозе 160 мг (высокие дозы – 320 мг/сут и более); – фарлутал используется в стандартной дозе – 500 мг/сут.
• При сравнении эффективности с тамоксифеном они значительно хуже переносятся больными из-за gыраженных побочных эффекrов, как: – увеличение массы тела (20-50% больных);
– кушингоидные симптомы;
– гипертензионный и гиперкаагуляционный синдромы;
– вагинальвыкровотечения.
• В последние годы начали активно изучатыя антипрогестины (онапристон, мефиприьон и Т.Д.):
– механизм их действия связан с антипрогестиновым и антиэстрогеновым действием, хотя до конца не ясен;
– однако эффективность значительно ниже, чем у классических антиэстрогенов.
- ·Поэтому конкуренции прогестинам и антиэстрогенам они не оказывают.
Заключение
- · «Золотым стандартом» гормонотерапии сегодня остается тамоксифен.
• II линию гормонотерапии прочно заняли ингибиторы (преимущественно селективные) ароматазы.
• Не исключено, что в последующем они выйдут в I линию гормонотерапии, конкурируя с антиэстрогенами.
• К III линии гормонотерапии на сегодняшний день следует относить прогестины (мегейс, фарлутал).