Лечение рака молочной железы
Прежде чем остановиться на определенных вариантах лечения рака молочной железы, необходимо отметить, что РМЖ – одна из немногих опухолей, чувствительная ко всем существующим в современной онкологии видам терапии (лучевой, химиотерапии, эндокринной терапии). Во всех случаях алгоритм или план лечебных мероприятий складывается на основании оценки степени распространенности опухолевого процесса (стадии заболевания), а также на оценке ее биологических характеристик.
Хирургическое лечение рака молочной железы.
Хирургический этап – обязательный компонент лечебной программы рака молочной железы. Это – основной и инициальный вариант лечения больных Tis-2 N0-1 M0 стадий. При местнораспространенном процессе операция выполняется после индукционной терапии, включающей: химиотерапию; лучевую терапию; химио-лучевое лечение или эндокринотерапию в самостоятельном варианте, либо в комбинации с цитостатиками.
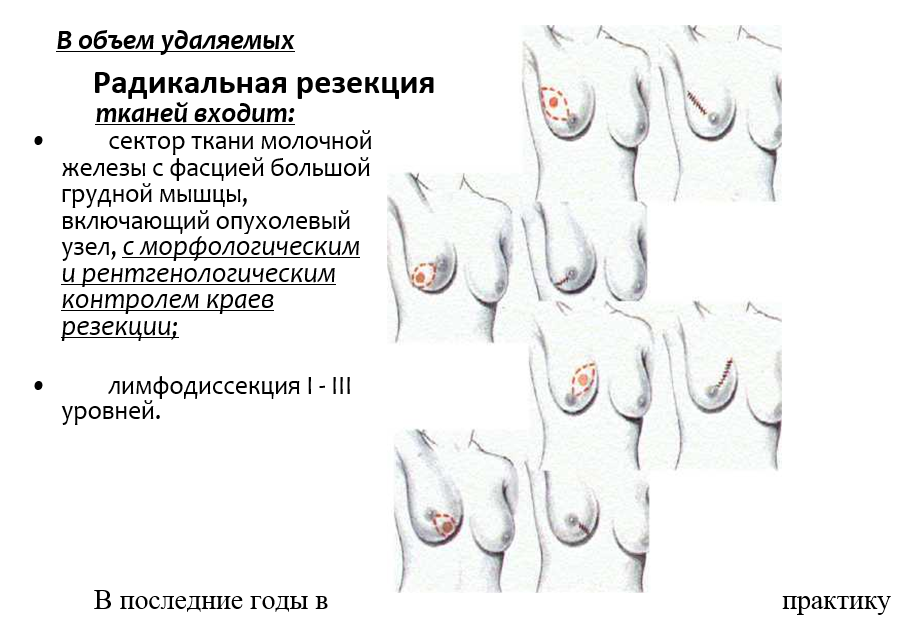
К современным стандартам хирургического лечения рака молочной железы относят: радикальную мастэктомию с сохранением обеих грудных мышц (модифицированная радикальная мастэктомия типа Маддена) и туморэктомию с лимфодиссекцией (в России более принят термин «радикальная резекция»)(рис .13,14).
Радикальная мастэктомия с сохранением грудных мышц
В объем удаляемых тканей в едином блоке включается:
- молочная железа вместе с фасцией большой грудной мышцы;
- лимфодиссекция I -III уровней;
- обе грудные мышцы сохраняются!
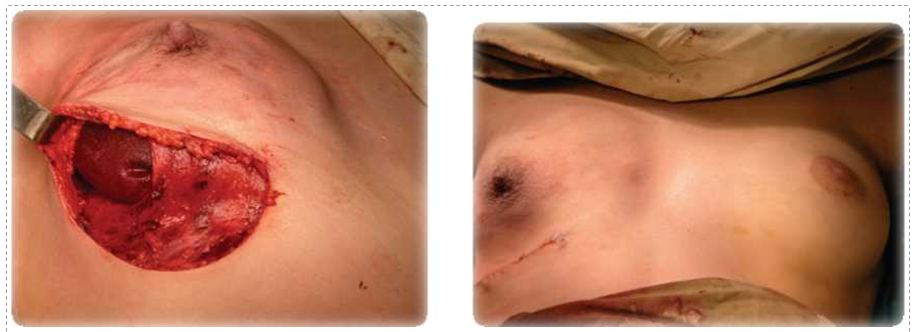
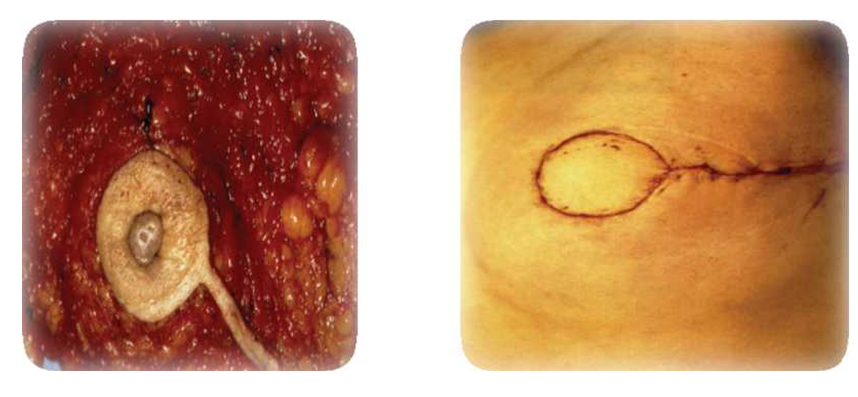
стали входить такие варианты хирургических вмешательств, как: кожесберегающая мастэктомия, подкожная мастэктомия. Реальным посылом для их практического внедрения является выявление опухолевого процесса на минимальных клинических
стадиях (рак in situ, начальный инфильтративный рак). Данные операции привлекательны, прежде всего, с косметических позиций, т.к. позволяют одномоментно выполнить реконструкцию молочной железы (имплант или экспандер-протез) рис.15-17).
Лимфодиссекттия
Статус регионарных лимфатических узлов является важнейшим фактором прогноза, достоверно влияющим как на общую, так и на безрецидивную выживаемость. В 20% случаев при неадекватной лимфодиссекции прогрессирование процесса связано с поражением этой зоны. Обычно в понятие «стандартной» лимфодиссекции включается удаление подлопаточно-подмышечных, межпекторальных , апикальных
Cтандарт хирургического стадирования при раке молочной железы.
При пальпаторно определяемом протоковом преинвазивном раке поражение регионарных лимфатических узлов отмечается не более, чем у 1,8% оперированных больных. При начальном инфильтративном раке вероятность метастазирования в регионарные лимфоузлы также невелика: для больных стадии Т1а она не превышает 3-7%, в случаях Т1Ь колеблется в интервале 8-19%.
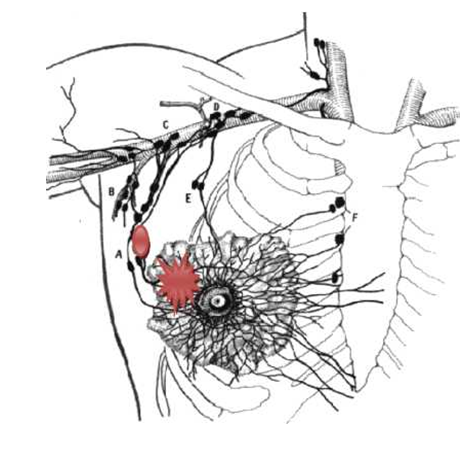
Небольшой процент поражения регионарных лимфатических узлов и возникающие после лимфодиссекции осложнения привели к появлению основного вопроса: объем лимфодиссекции. В этой связи была предложена, а по последним рекомендациям стала стандартом при минимальной болезни, методика исследования сторожевого или сигнального лимфатического узла (рис. 18)
Сигнальный или сторожевой лимфоузел – барьер, который первым поражается при регионарном прогрессировании;
Методика включает в себя пери- и интратуморальное введение: контрастного вещества и радионуклидного препарата. Первый необходим для макроскопической ориентации во время операции, второй позволяет четко определить уровень поражения лимфатических узлов. Удаленные препарат подвергается срочному интраоперационному морфологическому
исследованию, которое позволяет установить: отсутствие поражения в сигнальном лимфоузле, макро- или микро- метастатические изменения. При отсутствии поражения сентинального лимфоузла лимфодиссекция I – III уровней не является необходимой процедурой. В случаях обнаружения специфического поражения рекомендуется выполнение стандартной лимфаденэктомии.
Чувствительность исследования составляет 93-95%, специфичность – 100%.
Современные показания к применению методики приведены ниже.
Стандартные:
■Узловая форма рака <2см.
■Отсутствие метастазов в подмышечные лимфоузлы (клинически и по данным УЗИ).
Возможные:
■DCIS с фокусами микроинвазии.
■Мультифокальные опухоли.
■Размер опухоли >2см.
■Перед или после неоадъювантной терапии.
■ Пациентки категории N+.
■ Ранний РМЖ у мужчин.
Исследовании сторожевого лимфатического узла противопоказано, когда имеются пальпаторно определяемые аксиллярные лимфатические узлы, верифицированные в результате пункционной биопсии, или, когда клиническая стадия соответствует местно-распространенному процессу.
Лучевая терапия
При РМЖ может применяться как самостоятельно, так и в сочетании с другими методиками, включая операцию. Наиболее часто проводится облучение молочной железы, изолированно или с включением регионарных зон, после радикальных резекций.
В органосохраняющей программе лечения больных раком молочных желез послеоперационная лучевая после органосохраняющих операций обеспечивает высокие цифры локо-регионарного контроля и способствует снижению числа рецидивов с 15-40% до 5%. Лучевая терапия
на молочную железу проводится с двух тангенциальных полей. Адекватной считается суммарная очаговая доза (СОД) на молочную железу – 50 Гр.
При местнораспространенном раке молочной железы лучевая терапия применяется предоперационном и/или послеоперационном периодах.
Предоперационная лучевая терапия применяется при неоперабельном раке молочной железы с целью уменьшить объем опухоли и перевести ее в операбельное состояние, уничтожить пролиферирующие клетки опухоли и снизить вероятность диссеминации раковых элементов во время операции, обеспечить регионарный контроль, достичь частичной или полной регрессии регионарных метастазов. Рекомендуемая СОД на молочную железу и регионарные зоны – 50 Гр.
Лучевая терапия после радикальной мастэктомии у больных местнораспространенным раком молочной железы способствует снижению частоты локорегионарных рецидивов. Наиболее оптимальным и результативным является ее комбинация с адьювантной химиотерапией.
Химиотерапия при раке молочной железы может проводиться на всех этапах лечения.
До операции химиотерапия обычно используется в целях уменьшения размеров первичной опухоли и локо-регионарного метастазирования (сокращение стадии болезни) с целью последующего выполнения органосохранной операции. Другой вариант применения неоадъювантной (предоперационной) химиотерапии – при неоперабельном раке в целях наиболее эффективного воздействия на первичный очаг и регионарные метастазы для достижения оптимальных условий выполнения радикального хирургического вмешательства, а также для оценки индивидуальной чувствительности к проводимому лечению с возможной его коррекцией в дальнейшем.
Современная предоперационная химиотерапия включает в себя схемы с
анрациклинами и таксаны (в моно режиме или в комбинациях). Основные
режимы: 4FE100C, 4TAC. Иногда применяются пролонгированные режимы, такие как 4EC+4 доцетаксел, 4ЕС^4 паклитаксел,
4FElooC^цисплатин+доцетаксел. В случаях гиперэкспрессии или амплификации HER2 в комбинации обязательно входят таргетные агенты (трастузумаб, лапатиниб, пертузумаб).
Задачей послеоперационного системного лечения является профилактика метастатической болезни. Наиболее часто в современной химиотерапии используются режимы, объединяющие несколько препаратов либо разнонаправленного действия, либо взаимно усиливающие друг друга при сочетании.
Адьювантная терапия конца прошлого века связана с увеличением использования антрациклинов. К началу современного столетия в связи с появлением и клиническим применением таксанов. Сейчас к режимам с доказанной эффективностью относят: из схем «первого поколения»:CMF,
AC; «второго»- FAC, FEC, DC, AC/P; режимы «третьего» поколения-FEC/D, AC/wP, ddAC/P, TAC (таблица 2).
Таблица2. Эффективность различной полихимиотерапии антрациклины+таксаны vs без таксанов ^ (более 30 быс. пациенток; 82% с N+)).
|
Основные рекомендации, касающиеся применения различных вариантов химиотерапии в адьювантном лечении больных ранним раком молочной железы сводятся к следующему:
1) Режимы, включающие антрациклины/таксаны обеспечивают значительное увеличение как общей, так и безрецидивной продолжительности жизни;
2) Последовательное применение антрациклинов и таксанов более оправдано, т.к. при сохранении высокой эффективности, их
использование отличается лучшей переносимостью, нежели комбинированные режимы;
3) Наиболее эффекивные варианты применения таксанов: доцетаксел 1 раз в 3 нед., паклитаксел- 1 раз в нед.;
4) 4 ТС лучше, чем 4 АС, а наиболее оптимально их назначение в случае противопоказаний к введению антрациклинов;
Эндокринотерапия рака молочной железы.
РМЖ относится к гормонально зависимым опухолям. За более, чем сорокалетнюю историю изучения, сложились четкие представления взаимодействия гормонов и клеток-мишеней. Для понимания этого потребовалось клонировать рецептор (1987г.).
Рецепторы эстрадиола и прогестерона присутствуют как при раке, таки в случаях предраковой патологии молочных желез. Но, при раке их концентрация гораздо выше.
Ген первого из двух эстрадиоловых рецепторов (ER-a) располагается в 6 хромосоме. Сейчас известно два типа подобных рецепторов. ER-в, клонированный в 1990г., имеет меньшие размеры, локализован в 12 хромосоме. Комплекс этого типа рацепторов активирует зону эстрогенного ответа ткани.
Гормонотерапия один из самых эффективных и хорошо переносимых вариантов лечения как первичного, так и прогрессирующего РМЖ. Она эффективна в среднем у 1/3 больных. При наличии рецепторов обоих типов в опухоли эффективность метода достигает 50-70%, если есть рецепторы только одного типа, эффективность снижается до 33%.
Основными группами современной эндокринотерапии РМЖ являются антиэстрогены (Тамоксифен, Фазлодекс) и ингибиторы/инактиваторы ароматазы (Аримидекс, Фемара, Экземестан).
У молодых женщин репродуктивного возраста циркулирующие эстрогены активно продуцируются яичниками. Поэтому, помимо связывания рецептора антиэстрогенами, необходимо добиться максимального снижения уровня циркулирующих женских гормонов. Для этого сейчас используют: хирургическое удаление яичников (овариэктомия), лучевое воздействие на их ткань, «химическую кастрацию» с помощью агонистов рилизинг-факторов (Золадекс). Комбинация Золадекса и Тамоксифена – наиболее часто используемый вариант эндокринотерапии у пациенток с сохранной менструальной функцией, который позволяет на 50% снизить вероятность возврата заболевания и на 25% – показатель смертности от РМЖ. Кроме того, привлекательность данного способа овариэктомии состоит в его обратимости, т. е. при отмене препарата восстанавливается менструальный цикл и репродуктивный статус женщины.
Продолжительность приема Тамоксифена в дозе 20 мг/сутки не должна быть меньше 5 лет.
У женщин в период менопаузы источником эстрогенов являются не яичники, а надпочечники и жировая ткань. В этих органах под действием ароматазы (ключевой фермент реакции ароматизации) продуцируются эстрогены. Поэтому сейчас назначение антиэстрогенов при рецепторопозитивном РМЖ у женщин менопаузального возраста считается менее правильным, чем использование ингибиторов ароматазы. Таким образом, назначение Аримидекса/Фемары является гормонотерапией 1-й линии у менопаузальных больных с рецепторопозитивным РМЖ. Ингибиторы ароматазы сейчас могут быть использованы в качестве послеоперационного лечения при непереносимости или прогрессировании на фоне антиэстрогенов, а также до хирургического этапа при неоперабельных опухолях. Оказывая выраженный противоопухолевый эффект, гормонотерапия сохраняет хороший уровень качества жизни, не вызывая характерных для химиотерапии побочных эффектов – тошноту, рвоту, выпадение волос, анемию и лейкопению.
Таргетная или молекулярно-направленная терапия является важнейшим направлением современного лечения РМЖ.
В ее основе лежит разработка и использование препаратов, которые, прежде всего, воздействуют на молекулярные механизмы, отвечающие за рост и прогрессию опухоли. В последнее время появилось множество таргетных препаратов, рассматриваемых в качестве агентов для лечения больных РМЖ.
Прорыв в лекарственном лечении рака молочной железы, безусловно связан с клиническим внедрением первого молекулярно-направленного прерарата-трастузумаба(герцептин) при ИБК2-позитивном раке молочной железы.
Известно, что рецептор Her-2/neu присутствует и в нормальных тканях молочной железы человека — в среднем 20 000-50 000 рецепторов на поверхности клетки, однако их количество возрастает до 1 000 000 и более на поверхности раковых клеток. Имеются данные о том, что гиперэкспрессия более характерна для протокового, чем для долькового рака, редко выявляется при раке молочной железы у мужчин и при медуллярном раке. Известно также, что гиперэкспрессия характерна для болезни Педжета и воспалительной формы рака данной локализации.
Применение герцептина у больных раком молочной железы, резистентным к стандартной терапии, позволило зарегистрировать объективный лечебный эффект в 21 % случаев.
Сейчас трастузумаб- стандарт терапии НЕЯ-2 положительного рака молочной железы, и его включение в адьювантную терапию определяет достоверное увеличение выживаемости, снижение смертности, частоты местных рецидивов и отдаленных метастазов.
В настоящее время развиваются различные виды лекарственных средств, влияющие как на точки регуляции ангиогенеза в опухоли, так и, непосредственно, на сосуды. Среди них моноклональные антитела, ингибиторы тирозин-киназ, растворимые рецепторы, цитостатики в определенных дозах и многие другие.
Бевацизумаб (авастин) – гуманизированные моноклональные антитела с целенаправленным действием на VEGF.
В экспериментах на животных показано, что помимо блокирования образования новых сосудов анти-VEGF-терапия вызывает апоптоз клеток эндотелия, уменьшает диаметр, плотность и проницаемость существующих кровеносных сосудов, что влечет за собой гибель опухолевых клеток. Процесс блокирования неоангиогенеза и обратного развития типичных для опухоли незрелых сосудов создает условия для снижения сосудистой проницаемости, приводящего к уменьшению интерстициального давления в опухоли, что делает ее более доступной для химиотерапевтических препаратов. Кроме того, снижение интерстициального давления способствует уменьшению очагов гипоксии в опухоли, что повышает ее чувствительность к лучевой терапии. В настоящее время препарат используется в комбинациях с цитостатиками.
Лапатиниб – двойной ингибитор, действующий сразу на две мишени: EGFR (HER-1) и HER-2. Данные международных рандомизированных исследований свидетельствуют о высокой эффективности препарата как в комбинации со стандартными схемами химиотерапии, так и при трастузумаб – резистентном РМЖ. Важной особенностью лапатиниба является его активность в отношении метастазов в головной мозг, что обуславливает его показания в лечении метастатического РМЖ.
Современная тенденция фармакологии препаратов молекулярнонаправленного действия состоит в создании так называемых «панингибиторов»- лекарственных форм, блокирующих сразу несколько мишений сигнальных каскадов.
Нератиниб- необратимый мультитаргетный пан-IGFR-тирозин- киназный ингибитор. Препарат оказался эффективным в 1 линии лечения у 56% пациенток с диссеминированным раком молочной железы, и в 26% случаев при резистентности к трастузумабу.
Пертузумаб. Механизм действия связан с нарушением димеризации EGFR (предотвращает образование гомо- и гетеро-димеров). Являясь синергистом трастузумаба, он сохраняет эффективность при отсутствии гиперэкспрессии HER2 и резистентности к герцептину, особенно в комбинированных режимах (I линия адъювантного лечения: трастузумаб+ пертузумаб+доцетаксел).
Еще одной мишенью таргетной терапии рака молочной железы, ассоциированного с мутацией гена BRCA1 являются ингибиторы полирибозы-полимеразы (РАRР). Этот фермент играет ключевую роль в репарационных процессах ДНК, сшивая однонитиевые разрывы. При наличии мутаций BRCA1 возникает его функциональная неполноценность, которая препятствует осуществлению белково-репарационной функции. В результате этого становиться невозможной ДНК-репарация при двухнитиевых разрывах. Т.е. остается один путь- через полирибозу- полимеразу. Сейчас в различных фазах клинических исследований находятся несколько препаратов- ингибиторов РАRР.
BSI-201 в комбинации с цитостатиками (гемзар+карбоплатин) продемонстрировал высокую результативность (непосредственную и отдаленную) в лечении больных тройным негативным раком молочной железы.